INTRODUCCIÓN
Christian Guilleminault describió el año 1993 una nueva
entidad clínica en pacientes que por tener historia de hipersomnia
diurna y ronquidos, los hacía sospechosos de padecer un trastorno
respiratorio del sueño, pero que sin embargo presentaban estudio
polisomnográfico (PSG) sin apneas ni desaturación significativa
de oxígeno, por lo que eran entonces rotulados como hipersomnes
idiopáticos. Este grupo particular no evolucionó satisfactoriamente
con el uso de estimulantes del SNC, motivando un estudio más
detallado de esos PSG. Se observó entonces que dichos trazados
tenían un elevado número de microdespertares (interrupción
del sueño por aparición de actividad alfa durante 3 a
14 segundos), con un índice de frecuencia mayor a 10 de estos
eventos por hora de sueño. Estos microdespertares se asociaban
a un aumento de la resistencia de la vía aérea superior,
evidenciada por mayor negatividad de la presión esofágica.
Este autor constató que la terapia con presión positiva
continua sobre la vía aérea superior (CPAP nasal) controlaba
tanto la hipersomnia como el ronquido, ofreciendo una nueva posibilidad
de terapia específica a una porción de pacientes hasta
entonces tratados sólo sintomáticamente con estimulantes
del SNC y sin buenos resultados (1). Denominó a esta nueva condición
"Síndrome de resistencia de la vía aérea superior"
(SRVAS).
CLÍNICA
Aunque presenta los mismos síntomas ejes que la apnea de sueño,
es probable que esta condición sea muy subdiagnosticada, principalmente
porque el perfil de los pacientes es distinto. Se trata de un grupo
más joven, que no tiene preponderancia masculina (o al menos
no tan acentuada como en la apnea de sueño) y de peso más
normal. El síntoma central de este cuadro es la somnolencia diurna
excesiva (SDE), síntoma en general subvalorado que muchas veces
los pacientes no refieren como tal, describiéndolo más
bien como cansancio, fatigabilidad, decaimiento etc. Además en
ocasiones se confunde con depresión y fatiga crónica.
Generalmente existe roncopatía asociada, constituyendo a veces
ésta el motivo de consulta; su ausencia, particularmente en mujeres,
no descarta el diagnóstico. Afecta por igual a ambos sexos, a
diferencia de la apnea del sueño y es en general una patología
de pacientes normopesos y más jóvenes que los apnéicos.
En un trabajo previo el año 1982, se describió a niños
con resistencia aumentada de la vía aérea superior secundaria
a hipertrofia tonsilar y adenoídea, cuyos síntomas principales
incluían ronquidos, inquietud durante el sueño y diaforesis
(2). En la edad pediátrica, otros síntomas de presentación
pueden ser alteración del apetito, hiperactividad, disminución
del rendimiento escolar y trastornos conductuales (3).
FISIOPATOLOGÍA
La causa de la somnolencia diurna excesiva, síntoma cardinal
del SRVAS, es la presencia de muy frecuentes microdespertares a lo largo
de toda la noche, con la consiguiente fragmentación del sueño.
Este mecanismo productor de hipersomnia ha sido demostrado por diversos
autores en estudios experimentales, usando estímulos auditivos
de intensidad suficiente para inducir microdespertares, consiguiendo
reproducir la hipersomnia clínicamente así como cambios
en la vigilancia objetivables en el Test de latencias múltiples
del sueño (TLMS) (4,5,6). Por otra parte, la presencia de roncopatía
se ha establecido sólo como un factor asociado, el cual no es
necesario ni suficiente para condicionar esta patología (1,7).
El estímulo responsable de los microdespertares es el aumento
de la negatividad de la presión intratorácica y por lo
tanto de la vía aérea superior, que determina la disminución
del flujo aéreo, reflejando así el aumento de su resistencia
(1,8,9). Se ha definido la existencia de un umbral de presión
esofágica (Pes) para gatillar microdepertares, de aproximadamente
-15 cm H2O (9,10), considerando presión esofágica
basal normal de -5 a -10 cm H2O.
En sujetos normales, durante el sueño la vía aérea
superior se mantiene permeable gracias a la configuración anatómica
y tono muscular. En pacientes con trastornos respiratorios del sueño
la obstrucción, parcial o total, se produce a nivel retropalatino
o hipofaríngeo, pudiendo ser también multisegmentaria
o difusa. Está condicionada por variaciones anatómicas
individuales en la profundidad de la nasofaringe, presencia de tejido
redundante, retrognatia, macroglosia y grado de hipotonía de
la vía aérea superior, que en estos pacientes es mayor
que en la población normal (11). Este fenómeno genera
un círculo vicioso, ya que para vencer el aumento de resistencia
de la vía aérea superior se necesita incrementar la negatividad
de la presión intratorácica, que a su vez determina mayor
colapso.
En el trabajo de Guilleminault (1), el estudio cefalométrico
de los pacientes con SRVAS, demostró que el espacio posterior
a la base de la lengua (espacio retrolingual) estaba reducido en todos
ellos. Sin embargo, otro estudio con medición simultánea
de presión faríngea y esofágica durante el polisomnograma
(PSG) evidenció que en el 86% de los casos con SRVAS, el aumento
de resistencia estaba localizado en el velofarinx (12).
Existen hallazgos de trabajos experimentales (anestesia de la vía
aérea superior con lidocaína al 4%) que demuestran que
el cese del flujo aéreo determina aumento de la duración
de los microdespertares (13), disminución de la actividad muscular
del geniogloso, prolongación de las apneas y aumento de la negatividad
de la Pes antes del término de la apnea (14), sugiriendo la participación
de mecanorreceptores de la vía aérea superior como mediadores
del estímulo que gatilla los microdespertares.
Se desconoce por qué existen diferentes umbrales para el despertar
entre pacientes con SRVAS y síndrome de apnea/hipopnea obstructiva
del sueño (SAHOS) y cuáles son las condiciones que determinan
que en los primeros baste el ronquido para producir el microdespertar
y en los segundos se requieran apneas asociadas a hipoxia o hipercapnia
para producir el mismo fenómeno. Probablemente el mecanismo neural
reflejo que regula el tono musculoesquelético sea más
sensible en pacientes con SRVAS.
DIAGNÓSTICO
Frente al paciente con hipersomnia es fundamental una buena historia
clínica general con especial énfasis en el sueño
y obviamente un completo examen físico que permita reconocer
factores predisponentes como retrognatia, macroglosia, paladar ojival
etc y descartar otras causas de SDE. La magnitud de la hipersomnia se
puede establecer de acuerdo a su grado de interferencia con las actividades
de la vidad diaria, mediante cuestionarios previamente validados como
la Escala de Somnolencia de Epworth (ESE) (15), "Sleep Questionnaire
and Assesment of Wakefulness" (16) y más objetivamente con pruebas
de laboratorio como el TLMS (17) y el Test de Mantención de la
Vigilia (18).
Las causas más frecuentes de somnolencia a considerar dentro
del diagnóstico diferencial del SRVAS están enumeradas
en la Tabla 1.
Tabla 1
|
Diagnóstico diferencial de la Hipersomnia (19)
|
- Sueño insuficiente/Privación crónica
de sueño
- Trastornos respiratorios del sueño (TRS)
- Síndrome de apnea/hipopnea obstructiva del sueño
- Síndrome de resistencia de la vía aérea
superior
- Movimientos periódicos de extremidades
- Narcolepsia
- Hipersomnias recurrentes (Síndrome de Kleine-Levin,
hipersomnia asociada a la menstruación)
- Hipersomnia idiopática
- Hipersomnia post- infecciosa
- Hipersomnia familiar
- Trastornos del ciclo circadiano
- Síndrome de fase retardada de sueño (pseudo
hipersomnia diurna)
- Síndrome de fase adelantada de sueño
- Síndrome de sueño-vigilia diferente a 24 horas
- Patrón de sueño-vigilia irregular
- Patología Psiquiátrica
- Trastornos del ánimo
- Hipersomnia psicógena
- Patología Neurológica
- Lesiones estructurales del SNC (tumores, AVE, enf. desmielinizantes,
encefalitis etc.)
- Epilepsia (actividad epiléptica nocturna)
- Post TEC
- Enf. degenerativas (Parkinson, Alzheimer, AMS, etc.)
- Enf. neuromusculares y neuropatías (condicionan
TRS)
- Patología médica general
- Anemia, hipotroidismo, asma, EPOC, dolor crónico
(artritis, fibromialgia, etc.), alcoholismo, disfunciones
urinarias, trastornos gastrointestinales, angina nocturna.
- Fármacos
- Sedantes, hipnóticos, ansiolíticos, antihistamínicos,
anticonvulsivantes, antidepresivos, neurolépticos,
antihipertensivos
|
El diagnóstico de SRVAS debe ser planteado en pacientes con
historia de hipersomnia diurna, asociada a ronquidos, cuyo polisomnograma
descarta la presencia de apneas y desaturación patológica
de oxígeno, pero sí demuestra frecuentes microdespertares
y ronquidos (Figura 1). En general el perfil de estos pacientes
corresponde a individuos normopesos con un rango de edad menor que la
de los pacientes apnéicos. Para fines prácticos debe ser
considerado un diagnóstico de descarte, siendo obligatorio completar
el estudio para eliminar otras causas de ESD.
|
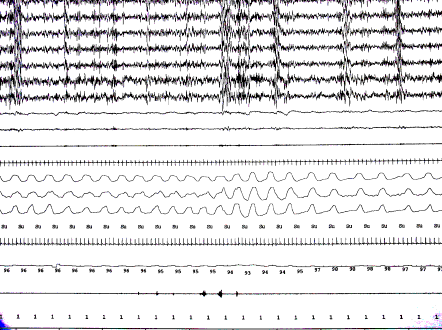
|
|
Figura 1
Registro polisomnográfico. Observe el microdespertar (flecha
negra) en relación al ronquido (flecha blanca), sin relación
a desaturación ni apneas.
|
Guilleminault en su publicación original caracterizó
el SRVAS de acuerdo a los hallazgos en el polisomnograma que incluía
medición de presión esofágica y pneumotacografía
(cuantificación del flujo aéreo). Definió como
microdespertar la aparición de actividad alfa de al menos 3 seg.
de duración (hasta 14 seg.), considerando patológico más
de 10 microdespertares por hora de sueño (1). En todos los casos
los microdespertares eran precedidos por un aumento de la negatividad
de la Pes. Se descartaron además otras causas de microdespertares.
Sin embargo, no existe un consenso respecto a la definición
del SRVAS en la literatura. Diversos autores han simplificado su definición,
considerándolo como un continuo con el SAHOS, siendo uno de los
extremos el ronquido (el más leve) y el otro la apnea del sueño
(el más severo), pasando naturalmente por el intermedio que correspondería
al SRVAS. Hay estudios que demuestran que pareando por sexo, edad e
índice de masa corporal a los pacientes con SRVAS versus SAHOS,
parámetros como la máxima negatividad de la Pes son similares
en ambos (20) y que la diferencia radicaría sólo en el
índice de apnea/hipopnea (21), estableciendo así al SRVAS
en la categoría de "NAREs" (non-apneic respiratory events, eventos
respiratorios no apneicos) o "RERAs" (respiratory effort related awakenings,
despertares inducidos por el esfuerzo respiratorio).
Además la mayor parte de los trabajos publicados no siguen pautas
estandarizadas para la identificación de los microdespertares,
rangos de Pes considerados anormales, índice de eventos respiratorios,
saturación de oxígeno etc.
Otros problemas diagnósticos son la necesidad de un estudio
invasivo para la medición de presión esofágica
y el uso de una mascarilla fuertemente adherida a la cara para la pneumotacografía,
ambas situaciones potencialmente capaces de interferir el sueño
por sí solas. Tradicionalmente se ha usado el termistor buco-nasal
para la detección de eventos respiratorios (pesquisando los cambios
de temperatura como reflejo del flujo aéreo) con resultados confiables
en el diagnóstico de apneas pero que evidencia claras limitaciones
en el caso de eventos más sutiles como son las hipopneas. Actualmente
está en práctica un sistema alternativo para el diagnóstico
de eventos respiratorios más sutiles, sistema que da una señal
de flujo cuantitativa que no requiere de mascarilla nasal como en el
caso de la pneumotacografía. Para esto se utiliza una cánula
nasal de oxígeno estándar alojada en las coanas, que a
su vez está conectada a un transductor que detecta cambios de
presión condicionados por la inspiración y espiración
(22,23,24). Al comparar la positividad del termistor versus cánula
nasal en la detección de eventos respiratorios, el termistor
sólo registra el 75% de los eventos en casos de SAHOS y el 39%
en SRVAS (22) o de otro modo, con el uso de cánula nasal (PTAF)
(Figura 2) se detecta un 302% más de eventos respiratorios
que con termistor en los casos de SRVAS (25).
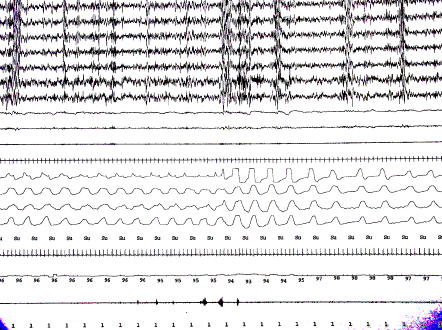
|
|
|
Figura 2
Registro polisomnográfico. Observe cómo el PTAF
(flecha blanca) detecta una disminución del flujo, no evidente
con el termistor (canal inmediatamente inferior), precediendo
inmediatamente al microdespertar (flecha negra).
|
En suma, estudios polisomnográficos que usan sólo termistor
oronasal, como ocurre mayoritariamente en nuestro medio, son insuficientes
para el diagnóstico de SRVAS especialmente. Sin embargo ante
la presencia de un alto índice de microdespertares en pacientes
roncadores con hipersomnia, se debe sospechar esta patología,
particularmente si además hay disminución del sueño
delta (etapas III/IV de sueño no REM). Cuando se cuenta con medición
de presión nasal se debe ser especialmente cauto en el diagnóstico
de hipopneas con este sistema y considerar siempre que deben asociarse
a caída en la saturación de oxígeno (2-3%) o reacción
de despertar subsecuente, para evitar falsos positivos y sobrediagnóstico.
TRATAMIENTO
Los pacientes con SRVAS deben ser tratados, puesto que la hipersomnia
crónica se asocia a una disminución de la calidad de vida,
compromiso del rendimiento laboral o académico (26-29) y a una
mayor ocurrencia de accidentes de tránsito (30) y laborales (31).
Está ampliamente demostrado que la apnea del sueño sin
tratamiento es causa de HTA, con todo el riesgo cardiovascular que esto
conlleva. Este último tiempo se ha observado además una
asociación significativa entre SAHOS y enfermedad cerebro vascular
(32); en cuyos casos la falla en el diagnóstico y tratamiento
de las apneas condiciona aumento de la mortalidad en estos pacientes.
En los casos más severos se describe también mayor incidencia
de cardiopatía coronaria, arritmias cardíacas, muerte
súbita y disminución del promedio de vida (25,33). Sin
embargo en el SRVAS sólo se ha demostrado una clara asociación
con HTA (34), suficiente para determinar indicación de tratamiento
en esta patología.
TRATAMIENTO MÉDICO
El tratamiento médico general debe indicarse siempre: reducción
de peso, eliminación del alcohol, fármacos depresores
del sistema nervioso central y relajantes musculares. También
es de utilidad evitar dormir en posición de decúbito dorsal.
El impacto de estas medidas no está estudiado en el SRVAS y su
beneficio sólo se ha demostrado parcialmente en los casos más
leves de SAHOS. Hay una comunicación anecdótica de un
caso de SRVAS controlado sólo con disminución de peso
(25).
CPAP
El estudio de Guilleminault (1) demuestra la utilidad del CPAP nasal
en el SRVAS, condicionando mejoría de la somnolencia diurna,
aumento de la latencia promedio de sueño en el TLMS, aumento
del sueño delta y disminución del número de microdespertares.
Posteriormente han aparecido otros trabajos que confirman estos hallazgos
(25,35,36).
CIRUGÍA
No existen trabajos comparativos ni randomizados sobre procedimientos
quirúrgicos en el SRVAS. Hay numerosos trabajos descriptivos
con muestras pequeñas, heterogenicidad de pacientes (mezcla de
SAHOS y SRVAS), criterios de inclusión y de procedimientos quirúrgicos,
que por lo tanto no permiten sacar conclusiones valederas.
Existen numerosos procedimientos quirúrgicos propuestos para
el tratamiento de estos pacientes (11):
- Septoplastía con resección parcial de cornetes: básicamente
utilizado para la roncopatía, pero se ha observado que al disminuir
la resistencia nasal disminuye el número de microdespertares
(37).
- Uvuloplastía: esta puede ser láser asistida, disponible
en nuestro medio, o por radio frecuencia. La indicación habitual
está restringida a pacientes roncadores y sus resultados son
transitorios. Dentro de sus efectos colaterales destaca el dolor faríngeo,
que puede persistir por semanas. Existe una pequeña serie de
11 pacientes portadores de SRVAS con este procedimiento, en los que
se logró una reducción significativa de la somnolencia
diurna (33).
- Uvulopalatofaringoplastía tradicional (UPFP): se describe
un porcentaje de fracaso de alrededor de 50% en SAHOS.
- Osteotomía mandibular con avance lingual.
- Miotomía hioídea con avance geniogloso.
- Cirugía multinivel.
En el caso de pacientes con SRVAS sin respuesta al tratamiento médico
general y mala tolerancia del CPAP nasal, debiera considerarse la opción
quirúrgica, especialmente cuando haya factores anatómicos
predisponentes y potencialmente corregibles.
DISPOSITIVOS ORALES
Son aparatos diseñados con el objetivo de conseguir un progresivo
avance mandibular y lingual; su uso no está claramente definido
en SAHOS y aún menos en SRVAS.
Existen dos informes de casos con respuesta satisfactoria, dada por
disminución de los microdespertares, mejoría de la eficiencia
de sueño, normalización de la Pes y resolución
del ronquido (38,39). Además hay una pequeña serie de
8 sujetos tratados con estos dispositivos individualizados para cada
paciente, en los que se logró una disminución del índice
de RERA y de los microdespertares (40). La adherencia a este tipo de
tratamientos es de 50-90% y debieran tenerse en mente por sus grandes
ventajas en costo, aceptación y baja morbilidad.
REFERENCIAS:
- Guilleminault C, Stoohs R, Clerk A, et al. A cause of excessive daytime
sleepiness: The Upper Airway Resistance Syndrome. Chest 1993; 104: 781-787.
- Guilleminault C, Winkle R, Korobkin R, et al. Children and nocturnal
snoring: evaluation of the effects of sleep related respiratory resistive
load and daytime functioning. Eur J Pediatr 1982; 139: 165-171.
- Downey R, Perkin R, MacQuarrie J. Upper airway resistance syndrome:
sick, symptomatic but underrecognized. Sleep 1993; 16: 620-623.
- Philip P, Stoohs R, Castronovo C, Guilleminault C. Sleepiness and
performance under sleep fragmentation. Am Rev Respir Dis 1992; 145:
A447.
- Philip P, Stoohs R, Guilleminault C. Sleep fragmentation in normals:
a model for sleepiness associated with upper airway resistance syndrome.
Sleep 1994; 17: 242-247.
- Martin S, Engleman H, Douglas N. The effect of sleep fragmentation
on daytime function. Am J Respir Crit Care Med 1996; 153: 1328-1332.
- Berg S, Nash C, Cole P, et al. Arousals and nocturnal respiration
in symptomatic snorers and nonsnorers. Sleep 1997; 20: 1157-1161.
- Stoohs R, Guilleminault C. Snoring during NREM sleep: respiratory
timing, esophageal pressure, and EEG arousal. Respir Physiol 1991; 85:
151-167.
- Gleeson K, Zwillich C, White D. The influence of increasing ventilatory
effort on arousal from sleep. Am Rev Respir Dis 1990; 142: 295-300.
- Berry R, Light R. Effect of hyperoxia on the arousal response to airway
oclusion during sleep on normal subjects. Am Rev Respir Dis 1992; 146:
330-334.
- Newman J, Clerk A, Moore M, et al. Recognition and Surgical Management
of the Upper Airway Resistance Syndrome. Laryngoscope 1996, 106(9):1089-1093.
- Loube D, Andrada T. Upper airway resistance syndrome patients increase
resistance at the level of the velopharynx during sleep. Chest 1997;
112(3) (supplt 3):9S.
- Basner R, Ringler, E, Garpestad E, et al. Upper airway anesthesia
delays arousal from airway oclusion induced during human NREM sleep.
J Appl Physiol 1992; 73: 642-648.
- Berry R, McNeils M, Kouchi K, et al. Upper airway anesthesia reduces
phasic genioglossus activity during sleep apnea. Am J Respir Crit Care
Med 1997; 156: 127-132.
- Johns M. A new method for measuring daytime sleepiness: the Epworth
sleepiness scale. Sleep 1991; 14: 540-545.
- Douglas A, Bornstein R, Nino-Murcia G, et al. Creation of the ASDC
sleep disorders questionnaire. Sleep Res 1986; 15: 117.
- Carskadon M, Dement W, Mitler M, et al. Guidelines for the multiple
sleep latency test (MSLT): a standard measure of sleepiness. Sleep1986;
9: 519-524.
- Doghramji K, Mitler M, Sangal R, et al. A normative study of the maintenance
of wakefulness test (MWT). Electroencephalogr Clin Neurophysiol 1997;
103: 554-562.
- Guilleminault C, Brooks S. Excessive daytime sleepiness: A challenge
for the practising neurologist. Brain 2001; 124: 1482-1491.
- Loube D, Andrada T. Comparison of respiratory polysomnographic parameters
in matched cohorts of upper airway resistance syndrome and sleep apnea
patients. Chest 1998; 114(4) (suppl):270S-271S.
- Loube D, Andrada T. Comparison of Respiratory Polysomnographic Parameters
in Matched Cohorts of Upper Airway Resistance and Obstructive Sleep
Apnea Syndrome Patients. Chest 1999; 115(6):1519-1524.
- Norman R, Ahmed M, Walsleben J, et al. Detection of respiratory events
during NPSG: nasal cannula/pressure sensor versus thermistor. Sleep
1997; 20: 1175-1184.
- Montserrat J, Farre R, Ballester E, et al. Evaluation of nasal prongs
for estimating nasal flow. Am J Respir Crit Care Med 1997; 155: 211-215.
- Hosselet J, Norman R, Ayappa I, et al. Detection of flow limitation
with a nasal cannula/pressure transducer system. Am J Respir Crit Care
Med 1998; 157: 1461-1467.
- Epstein M, Chicoine S, Hanumara R. Detection of Upper Airway Resistance
Syndrome Using a Nasal Cannula/Pressure Transducer. Chest 2000; 117(4):1073-1077.
- Partinen M. Epidemiology of sleep disorders. In Kryger M, Roth T,
Dement W, eds. Principles and Practice of Sleep Medicine. New York:
W.B. Saunders Co, 1994; 40.
- Coleman R. Diagnosis, treatment and follow up of about 8000 sleep
wake disorder patients. In Guilemminault C, Lugaresi E, eds. Sleep/Wake
Disorders: Natural History, Epidemiology, and Long-Term Evolution. New
York: Raven Press, 1983: 87-98.
- Mitler M, Carskadon M, CzeislerC, et al. Catastrophes. Sleep, and
public policy: consensus report. Sleep 1988; 11: 100-109.
- Folkard S. Shiftwork and performance. In: Johnson L, Tepas D, Colquhoun
W et al., eds. The Twenty Four-Hour Workday: Proceedings of a Symposium
on Variations in Work Sleep Schedules. Washington, D.C.: U.S. Government
Printing Office, 1981; 81:347-373.
- Findley L, Unverzagt M, Suratt P. Automobile accidents involving patients
with obstructive sleep apnea. Am Rev Respir Dis 1998; 138: 337-340.
- Leger D, Orvoen-Frija E, Laaban JP, et al. Motor vehicle accidents
and work-related conditions of 130 sleep apnea patients. Presented at
the Fourth World Congress on Sleep Apnea. San Francisco, CA, October
1994.
- Mohsenin V. Sleep-Related Breathing Disorders and Risk of Stroke.
Stroke 2001; 32(6):1271-1278.
- Utley D, Shin E, Clerk A, Terris D. A Cost-Effective and Rational
Surgical Approach to Patients With Snoring, Upper Airway Resistance
Syndrome, or Obstructive Sleep Apnea Syndrome. Laryngoscope1997; 107(6):726-734.
- Guilleminault C, Stoohs R, Shiomi T, et al. Upper Airway Resistance
Syndrome, Nocturnal Blood Pressure Monitoring, and Borderline Hypertension
1996; Chest. 109(4):901-908.
- Dahuja M, Castriotta R. The supine arousal index-a more relevant marker
for the upper airway resistance syndrome. Chest 2000; 118(4) (suppl):146S.
- Menzies R, Loube D, Andrada T, Griffin C. Efficacy of automatic continuous
positive airway pressure titration for the treatment of upper airway
resistance syndrome patients. Chest 1999; 116(4) (suppl 2):388S.
- Kerr P, Millar T, Buckle P, Kryger M. The importance of nasal resistance
in obstructive sleep apnea syndrome. J Otolaryngol 1992; 21: 189-195.
- Cuneo B, Loube D, Singer M. Successful treatment of upper airway resistance
syndrome with an oral appliance. Chest1997; 112(3) (suppl 3):166S.
- Guerrero M, Kristo D. Retrolingual enlargement causing the upper airway
resistance syndrome with successful treatment using an airway dilator.
Chest 2000; 118(4) (suppl):282S.
- Loube D, Andrada T, Griffin C. Oral appliance treatment efficacy for
upper airway resistance syndrome. Chest 1999; 116(4) (suppl 2):388S.
|


