Introducción:
La Enfermedad de Parkinson (EP) es una enfermedad degenerativa progresiva
de los ganglios basales caracterizada patológicamente por la
pérdida de células dopaminérgicas de la pars compacta
de la sustancia nigra (Snc). Estas neuronas dopaminérgicas se
proyectan al estriado y a otras regiones de los ganglios basales involucradas
en el control motor.
Los signos cardinales de la EP son: temblor de reposo; rigidez; bradiquinesia
e inestabilidad postural. El criterio diagnóstico incluye dos
de esos cuatro signos como así también, una respuesta
satisfactoria a levodopa (L-dopa).
El tratamiento quirúrgico comienza en la década de los
40 con la ablación quirúrgica de regiones del globus palllidus
interno (GPi) y motoras del tálamo. Decae esta técnica
con el advenimiento de la terapia con levodopa en las décadas
de los 60 y 70. Sin embargo, cuando se empiezan a observar efectos indeseados
de la L-dopa ya al 5º año de su uso, y además, se
produce gran avance en las técnicas quirúrgicas y exámenes
de imágenes, se renueva el interés en este tema (25).
La indicación general de la cirugía está destinada
a aquellos pacientes que están muy incapacitados por la progresión
misma de la enfermedad, refractarios a la terapia médica o con
severas fluctuaciones motoras y disquinesias asociadas a la terapia
con L-dopa (1,5).
Se contraindica el tratamiento quirúrgico en general a aquellos
pacientes que tienen un déficit cognitivo, edad mayor a 85 años,
portadores de un parkinson plus, hemianopsia ipsilateral y discrasia
sanguínea (5).
Fisiopatología:
Estudios con parkinsonismo inducido experimentalmente en primates ha
permitido la creacción de modelos de estudio y esquemas fisiopatológicos
que a la vez han permitido explicar los mecanismos de acción
de las terapias médicas y quirúrgicas. A saber:
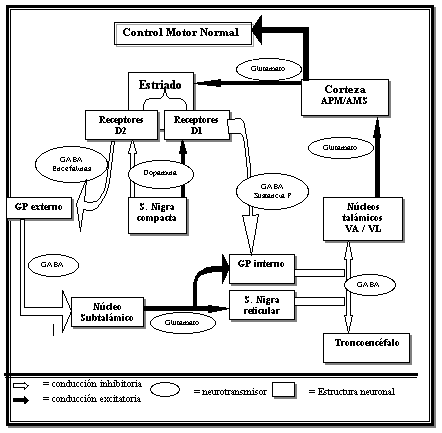
En el individuo normal: (Figura 1) El GPi y la pars reticular
de la sustancia nigra (Snr), ofrecen estímulos inhibitorios utilizando
el neurotransmisor GABA, a centros de control motor en tálamo
(grupos nucleares ventrolateral y ventralanterior) y en tronco cerebral
(núcleos pedúnculopontinos). Estos se encargan, a través
de la neurotransmisión con glutamato, de la estimulación
de centros corticales moduladores del movimiento (área premotora
y área motora suplementaria). El neoestriado (caudado y putamen),
posee receptores para la dopamina formada en la SNc. A su vez, el estriado
modula la acción de GPi y SNr a través de dos vías:
una directa que por la estimulación de receptores dopaminérgicos
D1 actúa por intermedio de GABA frenando al GPi y además,
otra vía indirecta que por inhibición de receptores D2,
actúa a través de GABA frenando al globus pallidus externo
(GPe) y éste a su vez inhibiendo al núcleo subtalámico
(NST). Este, utilizando glutamato, es el principal centro estimulador
de la acción de GPi y SNr (12).
Figura 1:
Esquema del control motor normal. (12)
En el paciente con EP: La entrega pobre e intermitente de dopamina
al neoestriado por parte de una SNc en degeneración, favorece
la acción inhibitoria de receptores D2 sobre el GPe lo que lleva
a una disminución de la normal inhibición del NST, así,
éste produce una gran estimulación de GPi y SNr los que
a su vez frenan fuertemente la acción de tálamo y tronco
y por ende también la acción de los centros corticales
del control motor (12).
Opciones del tratamiento quirúrgico:
- Ablación quirúrgica:
- Tálamo
- G. Pálido interno
- Subtálamo
- Estimulación cerebral profunda crónica:
- Tálamo
- G. Pálido interno
- Subtálamo
- Terapia restaurativa:
- Transplante adrenal autólogo
- Transplante de tejido mesencefálico embrionario humano
- Otras en estudio:
- Xenotransplante de células fetales porcinas
- Factor de crecimiento neuronal
- Xenotransplante en microcápsulas sintéticas
- Transferencia génica
Aspectos técnicos de la cirugía: (1,2,4,14,15,20,25)
Se describen a continuación algunos aspectos globales respecto
a las técnicas de cirugía ablativa y de estimulación
crónica cerebral profunda (ECP):
A.- Generalidades:
El paciente es estudiado previamente para descartar discrasias sanguíneas,
se suspende su medicación antiparkinsoniana por un lapso de
12 horas previo a la cirugía. Se utiliza sólo anestesia
local para la colocación del marco estereotáxico y anestesia
general en caso de implante de un estimulador después de que
ha sido evaluado el blanco clínica y electrofisiológicamente
con estimulación.
B.- Localización del blanco:
Los métodos de localización apuntan a estructuras que
clínica y fisiológicamente han mostrado tener un papel
preponderante en el control de la función motora, en el globus
palidus el blanco es la región ventropostero medial del globus
palidus interno (Gpi); en el subtálamo el blanco es el núcleo
subtalámico ( NST) y en el tálamo el blanco es el núcleo
ventrointermedio (Vim), el cual forma parte del grupo nuclear ventrolateral.
Se describen 3 métodos de localización que pueden ser
complementarios: estereotaxia guiada por imágenes; mapeo con
microelectrodos y macroestimulación. La mayoría de los
centros utilizan las imágenes y la macroestimulación,
el uso de microelectrodos no ha sido bien establecido.
Localización guiada por imágenes: La Resonancia
Magnética (RM) ofrece sobre la Tomografía Computada
(TC) la ventaja de una precisa visualización de los bordes
de los núcleos, sin embargo presenta como desventaja efectos
de distorsión espacial que puede variar ampliamente entre distintos
protocolos. La precisión máxima teórica de sistemas
estereotáxicos standard con imágenes basadas en cortes
de 1 mm en TC es de 1,5 mm con un límite de confianza del 95
%. Sin embargo la gran mayoría de los centros están
utilizando la RM.
Microestimulación: Las técnicas más comunes
son: registro de potencial único; potenciales de acción
extracelular usando tungsteno y microelectrodos de platino-iridio.
Diferentes ganglios basales tienen patrones característicos
de descarga espontánea que son fáciles de identificar.
Presentan alta resolución espacial con precisión submilimétrica.
Para el blanco palidal, su papel ha sido debatido por el hecho de
que los resultados clínicos no varían entre los centros
que sí y no la usan.
Macroestimulación: Provee un chequeo final del blanco
antes de la lesión o colocación del estimulador al dar
estímulos que provocan una respuesta evocada visual, motora
y sensorial por activación del tracto óptico, tracto
corticoespinal y vías somestésicas respectivamente.
También es importante como guía para la colocación
de estimuladores la supresión en el intraoperatorio del temblor
o de la rigidez e hipoquinesia.
C.- Técnica lesional para ablación quirúrgica:
La más común para generar una lesión es la termocoagulación
por radiofrecuencia consistente en una corriente alterna a una radiofrecuencia
de 500.000 Hz a través de un electrodo monopolar produciendo
un campo eléctrico oscilante con movimiento de electrolitos
lo suficiente como para causar un significativo calor por fricción.
Temperaturas sobre 45ºC producen destrucción tisular permanente.
El coágulo tiene un diámetro de 1 a 6 mm para temperaturas
de 60 a 80ºC por 60 segundos. El volumen promedio de la lesión
es de 75 mm3, de 44 a 127 mm3 en distintos estudios.
Otras técnicas se están probando como la radiocirugía
en donde se genera una lesión por radionecrosis, también
en primates se está probando la lesión química
por infusión local de excitotoxinas.
D.- Hardware para la estimulación cerebral profunda:
El aparato de uso más común para estimulación
cerebral crónica profunda (ECP) es el Medtronic con electrodo
cuadripolar. El estimulador tiene 4 contactos de platino-iridio separados
entre sí. Uno de ellos puede usarse como estimulación
monopolar, dos de ellos como bipolar y los parámetros de amplitud
del pulso, amplitud y frecuencia de estimulación pueden ajustarse
a criterio del médico por medio de un programa externo. Esta
estimulación es a alta frecuencia (100 a 180 Hz). El paciente
a su vez, puede encender o apagar el estimulador a través de
un magneto externo. El sistema se conecta a un generador de pulso
programable operado a batería implantado subcutáneamente
en el área infraclavicular . La batería tiene una duración
de 5 años con un uso medio de 16 horas diarias, generalmente
se recambia el generador de pulso completo.
Escalas de evaluación:
Con el objetivo de cuantificar y comparar resultados clínicos
de los procedimientos quirúrgicos se han utilizado escalas estandarizadas
de función motora e incapacidad, las más usadas son:
CAPIT (Core Assessment Program for Intracerebral Transplantation):
La principal escala de este protocolo es la UPDRS (Unified Parkinson's
Disease Rating Scale). Esta escala tiene 4 subescalas: 1: estado mental,
conducta y humor; 2: actividades de la vida diaria (ADL); 3: examen
motor y 4: complicaciones de la terapia. El puntaje total de la UPDRS
varía de 0 (asintomático) a 199 (incapacidad severa).
Por lo tanto, los mejores resultados son aquellos con scores más
bajos (25).
Tálamotomia:
Fue el principal tratamiento quirúrgico de parkinsonismo por
varios años desde la década de los 40 hasta la llegada
de la L-dopa. Aún es usado para diversas formas de temblor: parkinsoniano,
esencial y cerebeloso.
En el tálamo, los grupos nucleares ventrales anterior y lateral,
corresponden a los núcleos motores, en ellos, el área
receptora de aferencias cerebelosas es el nucleo ventrointermedio (Vim)
del grupo ventrolateral y sus eferencias se proyectan a la corteza motora;
las aferencias del GPi llegan a los núcleos ventraloralposterior
(Vop) y ventraloralanterior y las de la SNr al lateropolar, magnocelular
y sus eferencias se proyectan a las cortezas suplementaria y premotora
(25).
El mecanismo de acción es desconocido, se cree sea debido a
la destrucción de la actividad autónoma de neuronas que
descargan a la misma frecuencia que el temblor, estas "células
temblorogénicas" como algunos autores las llaman, son encontradas
en áreas de aferencias cerebelosas y palidales como Vim y Vop
(8, 22, 25).
La mejoría en el temblor y rigidez de extremidades contralateral
al lado de la lesión en el Vim ocurre cualitativamente en más
del 80 % de los pacientes. En el seguimiento entre 2 a 15 años
en diversos estudios , la recurrencia del temblor en general es mínima,
sin embargo los datos varían desde nula recurrencia (Jankovic,
36 pacientes, 5 años) hasta una serie de 57 pacientes con 43
% a 10 años (Kelly y Gillinham,1980) . Otros síntomas
parkinsonianos como la bradiquinesia mejora sólo parcial y transitoriamente
(8, 22)
Se han descrito efectos adversos transitorios como: somnolencia, confusión,
hemiparesia, ataxia de extremidades y de tronco, convulsiones, disartria
y afasia de expresión en cirugía del hemisferio dominante.
Efectos adversos permanentes como alteración del lenguaje (37
%), déficit cognitivo (18 %) y movimientos involuntarios se han
descrito con talamotomía bilateral (8, 22). Pacientes con alteración
cognitiva previa a la operación tienen un aumentado riesgo de
déficit cognitivo adicional (25).
La tasa de mortalidad alcanza al 0,3 % y se describe en relación
a hemorragia de ganglios basales y complicaciones médicas infecciosas
o embólica pulmonar (25).
Estimulación talámica:
Frecuentemente se ha señalado que durante la talamotomía,
la estimulación del Vim tiene el mismo efecto que su destrucción
. Los estudios al respecto han mostrado que la estimulación cerebral
crónica profunda (ECP) tiene similares resultados que la talamotomía
(la mayoría de las series muestran una marcada resolución
del temblor en el 88 % de los casos (25)), además, muestra ventajas
técnicas como que: es reversible, es posible modificar el estímulo
para mejorar eficacia o disminuir efectos colaterales y es posible de
implantar bilateralmente sin causar alteración cognitiva ni del
lenguaje (como se describe para la talamotomía bilateral). En
un reporte reciente además de Limousin y cols., señalan
una mejoría significativa en la rigidez y akinesia contralateral
en un seguimiento a 12 meses (11, 15).
Las reacciones adversas son leves y transitorias: parestesias, distonía
de extremidades, desequilibrio y más comunmente disartria hasta
en el 30 % en algunos estudios (8, 22, 25). En un reciente estudio multicéntrico
prospectivo doble-ciego (Koller y cols, 1997), evidenciaron mejoría
del temblor en EP en el 90 % de los casos siendo marcada en el 58 %
; la reacción adversa que observaron con más frecuencia
fue parestesias transitorias en el 80 % los primeros 3 meses disminuyendo
a un 21 % a los 12 meses de seguimiento (7). Se han descrito hematomas
intracraneanos sintomáticos no secuelares y asintomáticos,
también crisis convulsivas en casos aislados (8, 15).
El mecanismo de acción preciso es desconocido, se sugiere que
sea el efecto de la sobreposición de señales oscilatorias
de una frecuencia constante sobre señales oscilatorias anormales
de las células con descarga autónoma que mencionamos para
la talamotomía (8, 22, 25).
Un efecto de microtalamotomía podría explicar una supresión
del temblor adicional que ocurre tempranamente en la cirugía
aunque temporal (8).
Los efectos a largo plazo de la ECP no son bien conocidos, en un reporte
de autopsia de un paciente portador por 8 años de un estimulador
implantado en el Vim, sólo se evidenció una leve gliosis
circundante. En gatos se ha encontrado proliferación de sinapsis
en la corteza pudiendo esto afectar algunos patrones motores (25).
Pálidotomia:
En teoría, la interrupción de la actividad de la región
motora del GPi debería disminuir la influencia inhibitoria al
tálamo motor y restaurar la actividad tálamocortical disminuyendo
así los síntomas parkinsonianos (12, 25).
Aunque esta técnica comenzó su uso en la década
de los 50 después de que Cooper observó la mejoría
de los signos parkinsonianos en un paciente con un infarto en el GPi
secundario a la ligadura accidental de la arteria coroidea anterior,
sus resultados fueron inconsistentes debido posiblemente a una inapropiada
selección del blanco, situación que actualmente ha mejorado
gracias a la gran resolución de imágenes de resonancia
magnética y mayor precisión en las técnicas de
estereotaxia (8, 22).
El blanco anatómico se localiza habitualmente a 20 mm lateral
a la línea media, 7 mm bajo el plano entre las comisuras blancas
anterior y posterior y 2 mm delante del punto mediocomisural (1, 2,
25).
En una serie de 18 pacientes operados y 7 pacientes como grupo control
(Dogali y cols, 1995), se ha objetivado hasta un 65 % de mejoría
global en los scores de UPDRS (United Parkinson's Disease Rating Scale)
principalmente en el estado "off". En el score de CAPIT (Core Assessment
Program for Intracerebral Transplantation) mejoría en un 38,2
% para el lado contralateral a la cirugía y en un 24,2 % para
el lado ipsilateral. El tiempo de marcha mejora en un 45 %. La mejoría
ocurre inmediatamente después de la cirugía y continua
por 3 - 12 meses después de ésta (1). A 3 años
de seguimiento de 11 de los 18 pacientes operados de este mismo estudio,
los puntajes de rating motor ADL de la UPDRS aún presentan sostenida
mejoría (2).
Lozano encontró un 92% de reducción de las disquinesias
en el lado contralateral al de la cirugía (1). Lang y cols.,
describen en un reciente estudio, mejoría de las disquinesias
además en el lado ipsilateral en un 42% aunque este efecto se
empieza a perder a partir del segundo año. En general, la mitad
de los pacientes recupera su autovalencia a los 6 meses de seguimiento
(13).
La mayoría de los estudios reportan significativa reducción
de la bradiquinesia y rigidez (80 - 90 %), del temblor (60 - 80 %),
y disquinesias inducidas por drogas, además de mejoría
en ambulación y lenguaje (1, 11).
Salvo en un estudio, no se han descrito mejorías significativas
de los scores UPDRS en el periodo "on" o éstas no han sido sostenidas
en el tiempo (8,13).
Dogali y cols. señalan una leve reducción en la dosis
de levodopa y agonistas dopaminérgicos a un año de seguimiento
postoperatorio, sin embargo, dan gran valor a este resultado al compararlo
con el grupo control (no quirúrgico) en que el aumento de la
dosis farmacológica promedio fue de un 32% (1).
Hubo en los primeros reportes hasta un 14 % de incidencia de defecto
de campo visual, presumiblemente por injuria del tracto óptico,
estas cifras disminuyeron considerablemente a un 2,5 % en los estudios
posteriores gracias al uso de microelectrodos de registro.
Como complicaciones, se han descrito casos aislados de paresia facial
transitoria, confusión, disartria moderada, hipofonía,
casos de hemorragia lobar frontal subclínica y otros casos con
infarto capsular que ocurre semanas o meses después de la palidotomía.
El uso de electrodos de registro podría teóricamente incrementar
el riesgo de hemorragia al haber mayor instrumentalización del
tejido cerebral, pero esto no se ha descrito en la literatura. Con la
palidotomía bilateral se han descrito alteraciones de la memoria
y otros problemas neuropsicológicos similares a depresión
severa (8, 22, 25). Algunos pacientes experimentaron excesiva ganancia
de peso (25).
También se han descrito paresias facial, bulbar o de extremidades
que ceden en un lapso de 6 semanas y probablemente se deban a edema
circundante a la lesión (13).
Como predictores del pronóstico postoperatorio se han analizado
algunas variables en donde se han reportado que existe una buena correlación
del beneficio de la palidotomía con: el hipermetabolismo del
núcleo lentiforme ipsilateral en la tomografía por emisión
de positrones (PET), también con el grado de beneficio por la
administración de L-dopa (25).
En la mayoría de los casos publicados la lesión
es creada por termocoagulación con radiofrecuencia. Otras técnicas
se han experimentado como la radiocirugía usando el leksell gamma
knife, en estas series la mejoría sintomática ocurre entre
un 50 - 77 % de los pacientes y sin reportarse complicaciones, sin embargo,
en estos pacientes no se usaron las escalas estandarizadas conocidas
haciendo a los resultados no comparables con los de otros estudios con
uso de radiofrecuencia (25).
La elección del blanco también puede afectar la tasa
de complicaciones, particularmente para la palidotomía bilateral.
Así, las complicaciones bulbares pueden ser causadas por daño
bilateral de fibras corticobulbares en la cápsula interna adyacente
al GPi. Los mejores candidatos han sido los pacientes con EP que no
toleran la levodopa o tienen severas disquinesias inducidas por drogas.
No son buenos candidatos aquellos con alteración cognitiva o
con parkinson plus (8, 22).
Estimulacion palidal:
Basándose en la ECP para el temblor, en 1993, Siegfried and
Lippitz implantaron dos electrodos en la región ventroposterolateral
del pálido, uno a cada lado en tres pacientes objetivando mejoría
en los scores de evaluación clínica y en las fluctuaciones
on-off hasta un año de seguimiento. Varios otros estudios subsecuentes
han mostrado resultados satisfactorios mostrando mejoría en el
temblor, rigidez, bradiquinesia y disquinesias inducidas por L-dopa;
incluso con reducción de los medicamentos antiparkinsonianos
hasta en un 50 % postcirugía si bien no en todos los estudios.
La cantidad de tiempo en "on" se incrementa significativamente en evaluaciones
a 3 meses de seguimiento (8, 22, 25). Hay varios casos en los que se
ha observado un beneficio mayor hacia los dos meses de comenzada la
estimulación y también hacia los tres meses y los scores
motores UPDRS con el estimulador en off han sido significativamente
mejores que los scores basales y los del período postoperatorio
inmediato, sugiriendo que los efectos de la estimulación persisten
después de que el estimulador es apagado, a diferencia de lo
observado en la estimulación talámica (25).
Kumar comparó los efectos de la palidotomía ventroposteromedial
y la estimulación del GPi. Objetivaron similar mejoría
en el estado "off" para el score motor UPDRS, la akinesia, rigidez,
marcha e inestabilidad postural (8, 22).
Como complicaciones se han descrito contados casos de hemorragia intracraneal
asintomática, también hemiparesia, distonía, corea
y parestesias transitorias (8, 25).
Pahwa y cols. publican en 1997 una serie de 5 casos con una media de
edad de 56 años y 16 años de EP, 3 de ellos con implante
bilateral, con resultados de mejoría en las subescalas de UPDRS
de un 25% para el score mental y de 19% de mejoría en el estado
"off" y de 42% en el estado "on" para los scores de actividad de la
vida diaria (ADL). Muestran también una categórica disminución
de las disquinesias en estado "on" de un 40 a un 12%. Estos pacientes
requirieron un promedio de 4,8 ajustes del estimulador y generalmente
durante el primer mes. Como efectos colaterales hubo un caso de hemorragia
asintomática y otros transitorios de trastorno del lenguaje y
hemiparesia, distonía y parestesias faciales (23).
Subtalamotomía:
El núcleo subtalámico de Luys tradicionalmente se ha
asociado a hemibalismo contralateral secundario a infarto o hemorragia.
Es una formación ovoidea altamente vascular y poblada por grandes
neuronas, localizada entre la porción peduncular de la cápsula
interna por lateral y la zona incierta y fibras del tracto del campo
H2 de Forel por medial, subyacendo en la sustancia nigra en su porción
más medial. (8)
La subtalamotomía actuaría modulando la excesiva actividad
que en la EP presenta el NST y que es responsable de la mayor inhibición
talámica y reducción de la conducción talamocortical
(12,22,25). Modelos en primates han confirmado que lesiones del núcleo
subtalámico disminuyen las descargas neuronales espontáneas
y evocadas por movimiento en el GPi aliviando los signos parkinsonianos
motores. (25)
Los reportes a la fecha son de pocos casos en los que en general se
señalan mejorías de los scores UPDRS hasta de un 75 %
(4).
Estudios también en animales muestran que la subtalamotomía
mejora la aquinesia, temblor y rigidez. En algunos casos mejora también
síntomas axiales como el "frezzing" (25).
En un estudio con 5 pacientes, uno de ellos sufrió como complicación
un gran infarto subtalámico asociado a hemicorea que apareció
a los 7 días postoperatorio (8, 22).
En modelos en ratas, la interrupción de la actividad en el NST,
puede proteger a la SNc de la degeneración adicional futura,
posiblemente por disminución de la liberación de aminoácidos
excitatorios (glutamato) en la SNr (25).
Estimulacion subtalamica:
Limousin y cols. fueron los primeros en reportar en 1995 la ECP en
núcleo subtalámico bilateral, en un paciente con sintomatología
severa el cual mostró con la estimulación unilateral,
mejoría similar a lo visto con L-dopa en el estado "on" pre-operatorio
en el lado contralateral. Con la estimulación bilateral se evidenció
mayor mejoría.
En muchos casos se presentan disquinesias las cuales ceden al ajustar
los parámetros de la estimulación (8,13). Benabid y cols.
en una serie de 5 casos observaron mejoría en los scores motores
UPDRS entre un 42 a 82 % a los 3 meses postcirugía. Estos resultados
son mejores o similares a los mostrados para la palidotomía unilateral
(25).
El riesgo de hemorragia intraparenquimatosa es de menos del 2%. Ocasionalmente,
la estimulación puede inducir efectos colaterales como ptosis
palpebral, diplopia, parestesias y movimientos involuntarios como corea,
efectos que ceden una vez que se ajustan los parámetros de la
estimulación (20).
En un reciente trabajo franco-alemán, (Krack y cols, 1998),
hacen un análisis retrospectivo de la ECP bilateral comparando
efectos y resultados entre el blanco palidal y el del NST con 5 y 8
casos respectivamente, con la salvedad de que comenzaron todos ellos
su EP antes de los 40 años de edad y desarrollaron severas disquinesias
por drogas previo a la cirugía. Encontraron en este tipo de pacientes
que los efectos entre ambos son similares para disminuir los síntomas
parkinsonianos, distonías del período "off" y disquinesias
por medicamentos, así también para el temblor y rigidez.
Hubo una significativa disminución de la aquinesia que favorece
a la ECP del NST (71 % de reducción) en casi el doble en relación
a la ECP del GPi (30 % de reducción) a 6 meses (10).
En una serie también reciente de 24 pacientes operados bilateralmente,
Limousin y cols (14), muestran significativa mejoría de los scores
de la calidad de actividades de la vida diaria (ADL) y examen motor
en el estado "off" en un promedio de un 60 % a un año de seguimiento.
Un paciente sufrió daño permanente de afasia y paresia
por un hematoma de 8 cm durante la implantación. Dieciocho pacientes
ganaron un promedio de 4 Kg de peso, similar a lo descrito en la palidotomía.
En base a evidencias experimentales como la microestimulación
del NST de que induce respuestas de corta latencia ortodrómicas
excitatorias en la SNc acoplado a un marcado aumento de la liberación
de dopamina, han llevado a postular la hipótesis de que la sobreactividad
del NST existente en la EP, produciría por intermedio del neurotransmisor
glutamato y receptores NMDA, un efecto citotóxico persistente
sobre las neuronas dopaminérgicas dañando tal vez la utilización
energética en las mitocondrias de éstas llevando a la
apoptosis, postulan entonces que mecanismos de inhibición de
esta sobreactividad del NST tendrían un efecto neuroprotector
en esta enfermedad (24).
Terapia restaurativa:
A continuación se describirán técnicas destinadas
a provocar una mayor función dopaminérgica en el paciente
con una SNc enferma, algunos con algún grado de uso y otras en
franca experimentación:
Transplante autologo de medula adrenal: Hacia fines de los 80,
varios centros protocolizaron el estudio de el efecto del transplante
de células de médula adrenal autóloga en el núcleo
caudado derecho usando una aproximación transcortical, los beneficios
se consideran sólo modestos (de hasta un 40 %) considerando de
que la más clara mejoría fue en la mayor funcionabilidad
durante el estado "off", la cual sin embargo, tiene un efecto transitorio
que se empieza a perder entre los 12 y 18 meses postcirugía.
El mecanismo no está del todo claro, existiría producción
dopaminérgica por el tejido adrenal, también se postula
la liberación de un factor trófico , no existe evidencia
además de que el tejido adrenal pueda producir dopamina en cantidad
suficiente como para suplir los déficits en un paciente con EP
(6,21).
Transplante de celulas nerviosas fetales: Desde los primeros
estudios iniciados en 1987, más de 200 pacientes han recibido
implante de tejido mesencefálico embrionario en el estriado (16).
Ontogénicamente, las neuronas nigrales dopaminérgicas
embrionarias, son detectadas en el mesencéfalo ventral a las
5 _ a 6 _ semanas de gestación y comienzan a extender sus procesos
dendríticos hacia las 8 semanas. La viabilidad de estas células
no ha sido observada en transplantes desde fetos humanos con edades
mayores a 9 semanas (9).
A 6 años de seguimiento, Wenning y cols (Suecia, 1997) utilizaron
la tomografía por emisión de positrones (PET) para la
visualización de fluorodopa marcada radiactivamente, tratando
de objetivar así la actividad de células dopaminérgicas
en 6 pacientes con transplante de neuronas de dopamina embriogénica
humana en estriado unilateral. Observaron que la tasa de captación
de fluorodopa en sitios sin transplantes había decaído
en un 31 %, en cambio, en aquellos sitios en los que se habían
implantado dichas células, esta tasa había aumentado en
un 265 %. Sin embargo, la recuperación funcional no va de la
mano con estos valores y varía considerablemente entre un paciente
y otro, postulan entonces la realización de implante en putamen
bilateral para lograr optimizar la recuperación funcional (26).
Un estudio anatomopatológico en un paciente fallecido por embolía
pulmonar y en quién se había realizado un transplante
de neuronas fetales con clara mejoría clínica desde el
tercer mes después de la cirugía evidenció la sobrevida
de estas neuronas en gran número, distribuídas en racimo
y con una morfología de mayor calidad que las propias neuronas
del paciente. Presentaron gran reinervación dopaminérgica
principalmente putaminal. No encontraron brotes de yemación en
las neuronas del huésped (9).
En la mayoría de los estudios se observa un empeoramiento inicial
de los síntomas por 3 meses luego de lo cual comienza una mejoría
que en rangos moderados es más evidente en disminuir la hipoquinesia
y la rigidez en el período "off". El temblor por lo general no
cambia (16).
Existe un constante debate entre quienes señalan esta técnica
como muy ventajosa y entre quienes la desestiman considerando aspectos
de dificultad técnica que la hace poco reproducible y como la
obtención de 4 a 7 fetos abortados, con los consiguientes problemas
éticos. Por otro lado existe la posibilidad teórica de
riesgo de transmisión de infecciones al tejido cerebral del huésped
(6).
Xenotransplante de celulas fetales porcinas: Aún en análisis
están los primeros estudios clínicos en pacientes con
EP en quienes se realizó transplante de células fetales
de cerdo en putamen y caudado bajo tratamiento inmunosupresor. Estudio
anatomopatológico en un paciente fallecido por causa no relacionada
evidenció la sobrevida y crecimiento en el estriato de estas
células por lo menos en un lapso de 8 meses . No está
claro la posibilidad de riesgo de infección con retrovirus u
otros virus lentos del porcino (17).
Otros en estudio:
Transplante de microcápsulas de agarosa-gel conteniendo células
productoras de dopamina: Células de la línea dopaminérgica
derivadas de un feocromocitoma de rata son insertas en una microcápsula
sintética con membrana semipermeable y xenotransplantadas a cerebros
de "cerditos de guinea". El estudio histológico muestra la sobrevida
de estas células por lo menos durante 100 días y sintetizan
dopamina a partir de las 5 semanas del implante (19).
Factor de crecimiento neuronal (GNDF): En modelos de parkinsonismo
inducido en animales, se inyecta GNDF en vías intranigral, intracaudado
o intraventricular. Se muestran resultados promisorios al observarse
mejoría parcial de síntomas parkinsonianos desde la tercera
semana (3). En una reciente revisión del tema, Lang señala
que un estudio clínico con pacientes con EP de inicio tardío
e inyección intraventricular de GNDF, debió detenerse
debido a su falta de eficacia y alta incidencia de efectos adversos.
No se dispone aún de estudios clínicos con inyección
intraparenquimatosa (11).
Transferencia génica: En un adenovirus modificado se
ha insertado el gen para la producción de GNDF, se inyectó
directamente a sustancia nigra de ratas, una semana más tarde
se indujo la muerte de células nigrales por medio de toxinas
usadas localmente en la mitad de ellas, 6 meses después el estudio
histológico mostró sólo una leve pérdida
neuronal en relación a las que no se usó la inyección
de este virus (18).
Conclusiones:
- La opción quirúrgica es una buena herramienta terapéutica
en el paciente con EP avanzado y tal vez más aún en el
de corta evolución, pero que comienza con fenómenos inducidos
por la levoterapia.
- El blanco talámico tiene su indicación en el paciente
con preferente síntoma de temblor; si es bilateral, debiera favorecerse
la ECP por sobre la talamotomía.
- En aquel paciente cuya mayor incapacidad está dada por disquinesias
inducidas por drogas dopaminérgicas, el blanco de elección
es el GPi, tanto ablación como ECP.
- La estimulación subtalámica ha mostrado resultados promisorios
y con efecto más fisiológico en teoría.
- Las técnicas de implante de tejido embrionario humano y/o de
porcino muestran resultados modestos al largo plazo y presentan cuestionamientos
desde el punto de vista técnico y ético.
- Al parecer, el futuro de esta enfermedad sufrirá cambios inesperados
cuando el desarrollo técnico y biomolecular permita la masificación
y real implementación de técnicas que favorezcan la acción
de factores de crecimiento neuronal y de síntesis química
en base a ingeniería genética.
Referencias:
- Dogali M., Fazzini E., Kolodny E., Eidelberg D. y cols. Stereotactic
ventral pallidotomy for Parkinson's disease. Neurology; 45: 753-761,
1995.
- Fazzini E., Dogali M., Sterio D., Eidelberg D. y cols. Stereotactic
pallidotomy for Parkinson's disease: A long-term follow-up of unilateral
pallidotomy. Neurology; 48: 1273-1277, 1997.
- Gash D., Zhang Z., Ovadia A., Cass W. Y cols. Functional recovery
in parkinsonian monkeys treated with GDNF. Nature; 380 (6571): 252-255,
1996.
- Gill S., Heywood P. Bilateral dorsolateral subthalamotomy
for advanced Parkinson's disease. The Lancet; 350 : 1224, 1997.
- Greenberg MS. Handbook of Neurosurgery. 4th ed.
Greenberg Graphics, Inc. Lakeland, Florida, 1997.
- Isacson O. Fetal nerve cell transplantation: advances in the
treatment of Parkinson's disease. On the Brain; 3 (1), 1994. (http://neurosurgery.mgh.harvard.edu/oisacson.htm).
- Koller W., Pahwa R., Busenbark K., Hubble J., Wilkinson S.
y cols. High-frequency unilateral thalamic stimulation in the treatment
of essential and parkinsonian tremor. Ann Neurol; 42: 292-299, 1997.
- Koller W., Wilkinson S., Pahwa R. Y Miyawaki E. Surgical treatment
options in Parkinson's disease. Neurosurgery Clinics of North America;
9 (2): 295-306, 1998.
- Kordower J., Freeman T., Snow B., Vingerhoets F. y cols. Neurophatological
evidence of graft survival and striatal reinnervation after the transplantation
of fetal mesencephalic tissue in a patient with Parkinson's disease.
N Engl J Med; 332: 1118-24, 1995.
- Krack P., Pollak P., Limousin P., Hoffmann D. y cols. Subthalamic
nucleus or internal pallidal stimulation in young onset parkinson's
disease. Brain ; 121: 451-457, 1998.
- Lang A. Surgery for Parkinson Disease: A Critical Evaluation
of the State of the Art. Arch Neurol; 57(8): 1118-1125, August 2000.
- Lang A. y Lozano A. Parkinson's disease: Second of two parts.
N Engl J Med; 339: 1130-1143, 1998.
- Lang A., Lozano A., Montgomery E., Duff J. y cols. Posteroventral
medial pallidotomy in advanced parkinson's disease. N Engl J Med; 337:
1036-1042, 1997.
- Limousin P., Krack P., Pollak P., Benazzouzz A. y cols. Electrical
Stimulation of the subthalamic nucleus in advanced parkinson's disease.
N Engl J Med; 339: 1105-11, 1998.
- Limousin P., Speelman JD., Gielen F.y Janssens M. Multicentre
European study of thalamic stimulation in parkinsonian and essential
tremor. J Neurol Neurosurg Psychiatry; 66: 289-296, 1999.
- Lindvall O. Neural transplantation: a hope for patients with
Parkinson's disease. NeuroReport; 8 (14): iii-x, 1997.
- Medical Publishing Co. Transplanted Pig Fetal Nerve Cells Survive
In Brains of Patients With PD. PD Update; 75: 473-74, 1997.
- Medical Publishing Co. Viruses to treat Parkinson's Disease.
PD Update; 74: 465-66, 1997.
- Miyoshi Y., Date I., Ohmoto T. e Iwata H. Histological analysis
of microencapsulated dopamine-secreting cells in agarose/poly (styrene
sulfonic acid) mixed gel xenotransplanted into the brain. Experimental
Neurology; 138: 169-175, 1996.
- NYU Medical Center. Subthalamic nucleus (STN) stimulation:
new horizons for the treatment of Parkinson's disease. Web:http://mens10.med.nyu.edu/CMD/stn_main.html
- Olanow C., Koller W., Goetz C., Stebbins G. y cols. Autologous
transplantation of adrenal medulla in parkinson's disease. 18-month
results. Arch Neurol, 47: 1286-1289, 1999.
- Pahwa R. Surgical treatment for Parkinson's disease. Ann Sy
Labb. 1998.
- Pahwa R., Wilkinson S., Smith D., lyons K. Y cols.High-frequency
stimulation of the globus pallidus for the treatment of Parkinson's
disease. Neurology, 49: 249-253, 1997.
- Rodríguez M., Obeso J. y Olanow W. Subthalamic nucleus-mediated
excitotoxicity in parkinson's disease: a target for neuroprotection.
Ann neurol; 44 (Suppl 1): S175-S188, 1998.
- Starr P., Vitek J., Bakay R. Ablative surgery and deep
brain stimulation for parkinson's disease. Neurosurgery; 43: 989-1015,
1998.
- Wenning G., Odin P., Morrish P., Rehncrona S. Y cols. Short-
and long-term survival and function of unilateral intrastriatal dopaminergic
grafts in parkinson's disease. Ann Neurol, 42: 95-107, 1997.
|

